L'IA est formée à détecter des signes d'avertissement dans les analyses de sang.
20/12/2024 10:42
Other Articles in Health

Mère derrière le régime d'actions de Martha's Rule
Près d'un appel téléphonique sur huit effectué dans le cadre du régime Martha's Rule a conduit à un changement de traitement qui pourrait sauver des vies, NHS England a révélé. Le programme permet aux patients qui se détériorent rapidement et à leurs familles qui estiment que leurs préoccupations so...
Read more
La confiance en santé mentale pourrait perdre son permis
NHS England dit que la confiance en santé mentale qui a traité le tueur qui a commis les attaques Nottingham doit assister à des réunions mensuelles de progrès pour discuter des améliorations ou de la perte de son permis. Valdo Calocane a reçu un ordre d'hôpital après avoir admis les meurtres de Ian...
Read more
Décès d'alcool à un niveau record en Angleterre
Il y a eu « une augmentation catastrophique » des décès causés uniquement par l'alcool en Angleterre au cours des quatre dernières années, selon les chiffres du gouvernement. Plus de 8 200 personnes sont mortes à cause de l'alcool en 2023 - une augmentation de 42 % par rapport à 2019 - le Nord-Est a...
Read more
Les hôpitaux radient 112 millions de livres de factures de patients étrangers
Entre 2018 et 2023, les hôpitaux londoniens ont radié plus de 112 millions de factures de traitement non payées de patients étrangers, selon les chiffres obtenus par la BBC. En vertu de la réglementation actuelle du NHS, les fiducies hospitalières en Angleterre doivent exiger des patients qui ne rés...
Read more
Même la morphine n'aide pas mes horribles douleurs
"C'était comme d'être poignardé, je serais sur mes mains et à genoux dans la douleur." Emily Handstock, 25 a lutté avec la douleur d'époque depuis 10 ans et a documenté l'agonie qu'elle a subie sur TikTok. « J'ai été admis à l'hôpital et la morphine a à peine touché les côtés », a-t-elle dit. Elle v...
Read more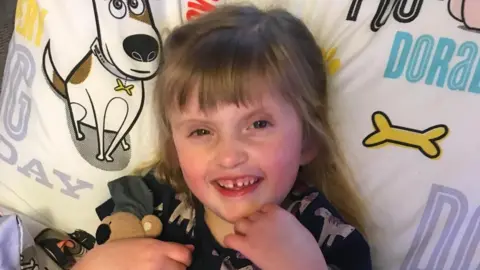
Mère de fille opérée par un chirurgien déshonoré dit que l'hôpital l'a assombrie
La mère d'une jeune fille opérée par un chirurgien déshonoré dans un célèbre hôpital pour enfants londonien a dit qu'elle n'aurait jamais dû être laissée à ses soins. Jodee Seeley a dit à BBC Newsnight qu'elle envisageait d'intenter une action en justice après le Great Ormond Street Hospital (Gosh),...
Read more
Hospices en Angleterre pour recevoir un soutien financier de 100 millions de livres
En Angleterre, les Hospices recevront 100 millions de fonds gouvernementaux sur deux ans pour améliorer les soins de fin de vie, a annoncé le secrétaire à la santé Wes Streeting. Un autre montant de 26 millions d'euros sera consacré à l'accueil des enfants et des jeunes, ce qui est une continuation...
Read more
Un bébé sur quatre en Angleterre né par Césarée
Un bébé sur quatre est maintenant né par la section césarienne, les dernières données du NHS pour l'Angleterre révèlent. Cette proportion a augmenté régulièrement au cours de la dernière décennie. Les experts disent qu'il est lié à un "nombre croissant" de grossesses plus "complexes" - parce que la...
Read more
Dartitis: La condition où vous essayez de jeter une fléchette - mais ne peut pas
L'ancien champion professionnel des fléchettes Kevin Painter lance des flèches presque tous les jours depuis 40 ans. Tout au long de sa carrière, il a prospéré sous la pression, jouant dans les compétitions les plus prestigieuses et ramenant à la maison plus de 900 000 en argent de prix. Mais au déb...
Read more
